УДК:616.62-006-018.25-018.7-091.8-092.18-037
И. И. Яковцова, Е. В. Титов, И. В. Ивахно, С. В. Данилюк, А. Б. Абдуллаева.
Харьковская медицинская академия последипломного образования
ЭКСПРЕССИЯ ВИМЕНТИНА, Е-КАДГЕРИН, TGF-β, ЦИТОКЕРАТИНОВ 7 И 20 В НЕИНВАЗИВНЫХ УРОТЕЛИАЛЬНЫХ РАКАХ МОЧЕВОГО ПУЗЫРЯ, КАК МАРКЕРЫ ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОЙ ТРАНСФОРМАЦИИ И КРИТЕРИИ ПРОГНОЗА ЗАБОЛЕВАНИЯ
Аннотация
Эпителиально-мезенхимальная трансформация (ЭМТ) может возникать в уротелиальных раках мочевого пузыря (УРМП) высокой степени малигнизации и ассоциироваться с возрастанием инвазивных свойств и метастазирвоанием. Целью исследования явилось изучение ЭМТ в неинвазивных УРМП (НУРМП) для выявления критериев рецидивирования и прогрессии заболевания. Исследована экспрессия виментина, Е-кадгерина, цитокератинов 7 и 20, TGF-β в НУРМП без рецидивов, первичных раках с рецидивами и с рецидивами и прогрессией. Установлено, что в раковых клетках 38,1% НУРМП появляется очаговая экспрессия виментина, которая ассоциируется с TGF-β (р<0,05), снижением экспрессии Е-кадгерина (р<0,05) и цитокератина 20 (р<0,01).
Ключевые слова: неинвазивный уротелиальный рак мочевого пузыря, эпителиально-мезенхимальная трансформация, виментин.
I. I. Yakovzova, Е. V. Titov, I. V. Ivakhno, S. V. Daniluk, A. B. Abdullaeva.
Kharkiv Medical Academy of postgraduate education.
EXPRESSION OF VIMENTINE, E-CADGERIN, TGF-β, CYTOCERATINES 7 AND 20 IN NONINVASIVE UROTHELIAL CANCERS OF BLADDER, AS MARKERS OF EPITELIAL-MEZENIMALAL TRANSFORMATION AND CRITERIA FOR PREDICTION OF THE DISEASE
Abstract
Epithelial-mesenchymal transformation (EMT) can appear in urothelial cancers of the bladder (UCB), especially high grade of malignancy, and is associated with an increase of invasive ability and metastatic progression. The purpose of present stady is to investigate the EMT in non-invasive UCB (NIUCB) to identify the criteria for recurrence and progression of the disease. We studied the expression of vimentin, E-cadherin, cytokeratins 7 and 20, TGF-β in NIUCB without recurrence, in primary NIUCB with recurrence and in NIUCB with recurrence and progression. It was found that in 38.1% of NIUCB, focal expression of vimentin in cancer cells appears, which is associated with TGF-β (p<0.05) expression, decrease of the E-cadherin (p<0.05) and cytokeratin 20 (p<0.01) expression.
Key words: non-invasive urothelial cancers of the bladder, Epithelial-mesenchymal transformation, vimentin.
Актуальность
Рак мочевого пузыря (РМП) в структуре онкологической заболеваемости занимает пятое место [1]. Уротелиальный рак, который является наиболее частой формой РМП, в 75% случаев выявляется на этапе неинвазивного роста [2]. Однако даже неинвазивные уротелиальные РМП (НУРМП) рецидивируют в 30-85% случаев, прогрессирование заболевания возникает в 10-30% [3]. Остается актуальным исследование характера течения НУРМП и поиск прогностических критериев заболевания для выбора лечебной тактики [4]. В раках различной локализации, и в УРМП в частности, прогностическое значение имеет эпителиально-мезенхимальная трансформация (ЭМТ), которая характеризуется частичной и полной утратой опухолевыми клетками эпителиального фенотипа при возрастании уровня экспрессии генов, ответственных за мезенхимальный фенотип [5], что приводит к повышеннию инвазивных свойств этих клеток и устойчивости к апоптозу [6]. Выявление ЭМТ в НУРМП на уровне световой микроскопии и при иммуногистохимическом исследовании даст возможность судить о биологическом поведении опухоли и прогнозе заболевания.
Целью исследования явилось изучение ЭМТ в НУРМП для выявления критериев рецидивирования и прогрессии заболевания.
Материалы и методы
Материалом послужили оперативно удаленные в Харьковском областном клиническом центре урологии и нефрологии им. В.И. Шаповалова уротелиальные раки мочевого пузыря стадии T1, т. е. без инвазии в мышечный слой стенки органа, числом 42 случая. Средний возраст пациентов составил 66,4±7,2 лет, мужчин было 83,3% (35/42), женщин –16,7% (7/42).
Материал был распределён на группы: неинвазивные УРМП (НУРМП) без рецидивирования – I группа (14 случаев), НУРМП с рецидивированием без прогрессии – II группа (14 случаев) и НУРМП с рецидивированием и прогрессией в виде инвазии в мышечный слой стенки – III группа (14 случаев).
Учитывалась также дифференцировка раков согласно последней классификации ВОЗ [7]. НУРМП низкой степени злокачественности (НУР НСЗ) – 24 (57,1%) случая и НУРМП высокой степени злокачественности (НУР ВСЗ) — 18 (42,9%) случаев. С целью исключения влияния не результаты исследования фактора дифференцировки опухоли, в каждой из групп исследования было взято равное число случаев НУРМП высокой и низкой степени злокачественности. Так из 14 случаев НУРМП I группы было 8 НУР НСЗ и 6 случаев НУР ВСЗ, во II и III группах соответственно также по 8 случаев НУР НСЗ и по 6 случаев НУР ВСЗ.
Иммуногистохимическое исследование проводилось с использованием первичных моноклональных антител (МКАТ) фирмы DAKO (Дания), Rady-to-Use к виментину, Е-кадгерину, цитокератину 20 (ЦК 20) и 7 (ЦК 7), TGF-β. Для оценки иммуногистохимической реакции использовали полуколичественную шкалу – учитывался процент экспрессирующих маркер клеток в поле зрения: 0 – отсутствие экспрессии, 1 — 1-33% клеток, 2 – 34 — 66% клеток, 3 – 67-100% клеток.
Статистическую обработку результатов исследования проводили с использованием пакета «Statistica 6.0». Связь между признаками оценивалась по непараметрическому критерию χ-квадрат Пирсона и критерию Спирмана. Статистически значимым считалось значение р<0,05.
Результаты и их обсуждение.
Была исследована экспрессия цитокератинов 7 и 20 раковыми клетками для суждения о возможном изменении эпителиального фенотипа.
ЦК 7 демонстрировал экспрессию во всех 42 случаях (100%), ЦК 20 – в 71,4% (30/42) случаев. По данным отдельных авторов уровень реакции ЦК 7 и 20 опухолевых клеток уротелиального рака зависит от дифференцировки рака и стадии Т опухоли [5]. В нашем исследовании выявлено отсутствие зависимости между дифференцировкой НУРМП и уровнем экспрессии ЦК 7 и отмечалось случайное распределение уровня иммунореактивности опухолевых клеток к данному маркеру. Выявлена достоверная зависимость между дифференцировкой НУРМП и уровнем экспрессии ЦК 20 (р=0,01,2=8,47). Так наибольшее относительное число случаев выраженной экспрессии ЦК 20 наблюдалось в НУР НСЗ — 48,1% (13/24), в то время как в группе с НУР ВСЗ было отмечено наименьшее относительное число таких случаев – 16,7% (3/18), что связано со снижением уровня экспрессии маркера при повышении степени злокачественности НУРМП.
Выявлена отрицательная умеренная связь r=-0,447 между уровнем экспрессии ЦК 7 и ЦК 20. Таким образом, при снижении уровня экспрессии ЦК 20 прослеживается повышение уровня экспрессии ЦК 7.
Не было выявлено зависимости между принадлежностью раков к группам исследования и экспрессией ЦК 7 и ЦК 20 при учете её уровня по полуколичественной шкале (см. табл. 1). Однако, отсутствие экспрессии ЦК 20 было не характерно для I группы (нерецидивирующих раков) (p<0,05, 2=4,72) и ассоциировалась с III группой (рецидивирующих с прогрессией) раков, что в целом может служить критерием прогноза заболевания. В отношении ЦК 7 выявлена противоположная слабая тенденция (p>0,05) в более выраженной реакции опухолевых клеток III группы и большим числом случаев со слабой реакцией ЦК 7 в I группе.
Е-кадгерин — является маркером межклеточной адгезии эпителиальных клеток, и утрата его экспрессии в раковых клетках является признаком частичной потери эпителиального фенотипа, а также критерием неблагоприятного прогноза для раков различной локализации [8]. В нашем материале раки демонстрировали слабую или умеренную мембранную экпрессию Е-кадгерина. Зависимости между индексом метки Е-кадгерина и принадлежностью опухолей к исследуемым группам не выявлена, однако в рецидивирующих раках (II группе) экспрессия Е-кадгерина несколько снижалась по сравнению с нерецидивирующими, а в рецидивирующих раках с прогрессией (III группе) была еще несколько ниже, чем в I и II группах (см. табл.1). При рассмотрении дифференцировки НУРМП, выявлено что НУР ВСЗ ассоциируются со слабой экспрессией Е-кадгерина (р<0,01, 2=6,93), которая наблюдалась в 94,4% (11/12) случаев и лишь в 5,6% (1/12) НУР ВСЗ были с умеренной экспрессией маркера, а опухоли с выраженной реакцией на Е-кадгерин отсутствовали. Слабая и умеренная экспрессия Е-кадгерина в НУР НСЗ была в 58,3% (14/24) и 41,7% (10/24) соответственно.
Виментин – является межуточным филаментом клеток мезенхимального происхождения и одним из широко используемых маркеров ЭМТ раков различной локализации [9]. В нашем материале отмечено появление слабой очаговой реакции опухолевых клеток в 38,1%(16/42) случаев. Как видно из табл. 1 отсутствует зависимость между экспрессией виментина и принадлежностью раков к исследуемым группам, однако отмечается тенденция возрастания относительного числа случаев со слабой позитивной реакцией на виментин в II и III группах по сравнению с I-ой.
Табл. 1
Распределение экспрессии виментина, Е-кадгерина, ЦК 20 и 7, TGF-β в НПРМП в зависимости от их принадлежности к группам исследования
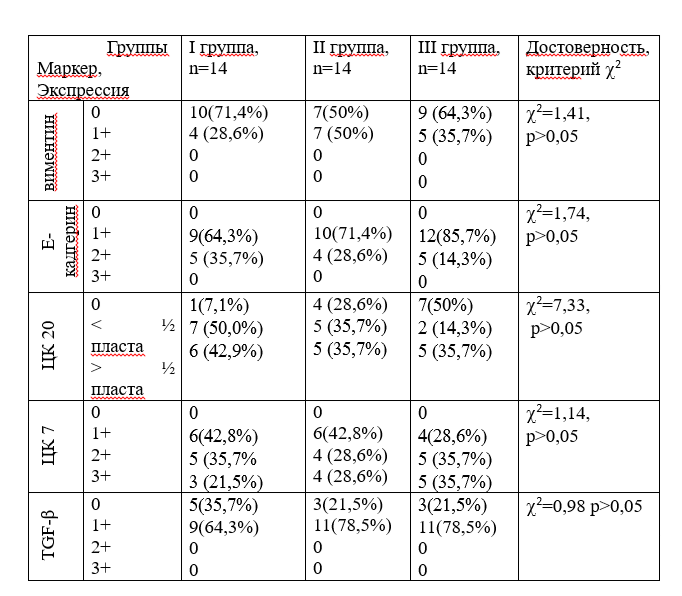
Следует отметить, что экспрессию виментина часто давали клетки с более крупными ядрами неправильной, вытянутой формы, что характеризует НУР ВСЗ. Соответственно обнаружена зависимость между высокой степенью злокачественности НУР и положительной реакцией на виментин (р<0,05, 2=4,07). По-видимому, отсутствие зависимости между появлением реакции на виментин и признаком принадлежностью НУР к исследованным группам объясняется взятым равным числом случаев НУР НСЗ и НУР ВСЗ в каждой из групп.
Таким образом, из исследованных маркеров лишь уровень экспрессии Е-кадгерина, виментина и ЦК 20 зависел от дифференцировки раков и не было ни одного маркера, уровень экспрессии которых в первичных раках зависел бы от их рецидивирования или рецидивирования с прогрессией.
При изучении взаимосвязи выше перечисленных маркеров в исследованных НУР выявлены следующие особенности. Обнаружена обратная корреляционная зависимость между экспрессией Е-кадгерина и виментина (r=-0,467, р<0,05). Так НУР, в которых появлялась слабая экспрессия виментина, демонстрировали в 38,1% (16/42) случаях слабую экспрессию Е-кадгерина, а в 26,2% (11/42) случаев НУР с умеренной реакцией и в 35,7% (15/42) случаев со слабой экспрессией Е-кадгерина наблюдали полную утрату экспрессии виментина.
Подобного рода обратная зависимость наблюдалась между ЦК 20 и виментином (r=-0,801, р<0,01): НУР, в которых появлялась экспрессия виментина в 75% (12/16) случаев демонстрировали полную утрату экспрессии ЦК20, а в 25% (4/16) экспрессия ЦК20 была слабой. Выявленная зависимость отображает общность процессов ЭМТ опухолевых клеток.
Фактором роста, который участвует в сигнальных путях ЭМТ раков различной локализации, в т.ч. уротелиальных, является TGF-β [10]. В нашем материале TGF-β демонстрировал слабую реакцию в 73,8% (31/42) случаев. Прочие в 26,2% (11/42) НУР характеризовались отрицательной реакцией опухолевых клеток. Отсутствовала достоверно значимая зависимость между экспрессией TGF-β и принадлежностью НУР к исследуемым группам, а также их дифференцировкой, что определяет TGF-β как маркер, который не может служить прогностическим критерием заболевания.
При рассмотрении взаимосвязи TGF-β с исследуемыми маркерами установлено, что в 38,1% (16/42) случаев наблюдалась коэкспрессия TGF-β1 и виментина, а в 26,2% (11/42) случаев при отрицательной экспрессии TGF-β1 экспрессия виментина также была отрицательной. Остальные случаи были со слабой экспрессией TGF-β1 и отрицательной экспрессией виментина. Установлена корреляционная зависимость между экспрессией TGF-β1 и виментина (r=0,46, р<0,05). Противоположную обратную зависимость обнаружена при сопоставлении TGF-β1 и Е-кадгерина (r=-0,94, р<0,01): во всех НУР с положительной реакцией клеток на TGF-β1, эспрессия Е-кадгеина снижалась и была слабой.
Таким образом, на молекулярно-биологическом уровне установлено появление процессов ЭМТ в НУР МП и вовлеченность в этот процесс TGF-β.
Выводы:
В результате микроскопического и иммуногистохимического исследования 42 случаев НУРМП с использованием маркеров ЭМТ (виментина, Е-кадгерина, цитокератина 7 и 20, TGF-β) получены следующие выводы.
-
-
-
- В НУРМП (стадии Т1) имеют место процессы ЭМТ, что на молекулярно-биологическом уровне выражается очаговым появлением в раковых клетках виментина (в 38,1%), ассоциированное со снижением Е-кадгерина (r=-0,467, р<0,05) и цитокератина 20 (r=-0,801, р<0,01).
- TGF-β вовлечен в процессы ЭМТ, что обнаруживается установленной корелляционной зависимостью между экспрессией TGF-β и виментина, (r=0,46, р<0,05), а также TGF-β1 и Е-кадгерина (r=-0,94, р<0,01).
- Установлено, что из всех исследованных маркеров ЭМТ отрицательная реакция на ЦК20 ассоциируется с рецидивированием и прогрессией НУРМП (р<0,05), что в целом может служить критерием прогноза заболевания. Появление экспрессии виментина, слабая экспрессии Е-кадгерина характерны для НУР ВСЗ (р<0,05 и р<0,01 соответственно).
- Выявлено, что с повышением степени злокачественности НУРМП, снижается уровень экспрессии ЦК 20. При снижении уровня экспрессии ЦК 20 повышается уровень экспрессии ЦК 7 (r= -0,447, р<0,05).
-
-
Перспектива исследования:
Перспективным является дальнейшее изучение эпителиально-мезенхимальной трансформации, которая характерна как для инвазивных, так и неинвазивных УРМП и может служить критерием агрессивного биологического поведения опухолей.
Список использованной литературы.
1. Breyer J. Increased Proliferation as Independent Predictor of Disease Recurrence in Initial Stage pTa Urothelial Bladder Cancer / J. Breyer, S. Shalekenov, A. Aziz [et al.] // Bladder Cancer. – 2017. – Vol. 3(3). – P. 173-80.
2. Bostwick DG. Urologic Surgical Pathology, 3th edition / DG Bostwick, L Cheng. // Philadelphia: USA: ELSEVIER Sanders. — 2014. — 1273 p.
3. Choi W. Intrinsic basal and Iuminal subtypes of muscle-invasive bladder cancer. / W. Choi, B. Czerniak, A. Ochoa [et al.] // Nat. Rev. Urol. – 2014. – Vol.11. – P. 400-10.
4. Queipo Z.J.A. Prognostic value for progression of the regulating proteins of the cellular cycle in pT1G3 bladder tumors / Z.J.A. Queipo, C.J.L. Ruiz, M.L. Palmero [et al.]. // Actas Urol. Esp. – 2005. – Vol. 29(3). P. 261–268.
5. Hammam O. Expression of cytokeratin 7, 20, 14 in urothelial carcinoma and squamous cell carcinoma of the Egyprian urinary bladder cancer. / O. Hammam, M. Wishahiz, H. Khalil [et al.] // J Egypt Soc Parasitol. – 2014. — Vol. 44(3). – P. 733-40.
6. Chang JC. Cancer stem cells: Role in tumor growth, recurrence, metastasis, and treatment resistance / J.C. Cang. // Medicine. – 2016. – Vol. 95. – P. 20-5.
7. Moch H.A., Ulbright T.M., Reuter V. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs. Lyon, France; International Agency for Research of Cancer; European Urology 70, 2016, p.101-119.
8. Люлько А.В. Оценка экспрессии маркеров клеточного цикла и межклеточной адгезии у пациентов с поверхностным раком мочевого пузыря / А. В. Люлько, Р. Н. Молчанов, И. С. Шпонька // Урологія. — 2012. — Т. 16, № 1. — С. 52-60.
9. Василенко И.В. Особенности эпителиально-мезенхимальной трансфор- мации в раках различной локализации и гистологического строения / И.В. Василенко, Р.Б. Кондратюк , А.Г. Кудряшов, Ю.К. Гульков, А.С. Малашкевич, Н.Н. Сургай // Клиническая онкология.-2012.-№5.-С.163-167.
10. Xia G. Transforming growth factor-β and smooth muscle differentiation. / G. Xia, C. Shi-You. // World J Biol Chem. – 2012.- Vol. 3(3). – P. 41–52.