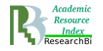Markovskyi V.D.
Doctor of medicine, professor the department of pathological anatomy Kharkiv National Medical University.
Zvereva I.S.
PhD student in Kharkiv National Medical University
Марковский Владимир Дмитриевич
доктор медицинских наук, профессор кафедры патологической анатомии Харьковского национального медицинского университета
Зверева Ирина Сергеевна
заочный аспирант кафедры патологической анатомии Харьковского национального медицинского университета
INFLUENCE OF MATERNAL STAFFLOCOCATE INFECTION ON PATHOMORPHOLOGICAL FEATURES OF PULMONARY ARTERY OF DESCENDANTS.
ВПЛИВ МАТЕРИНСЬКОЇ СТАФІЛОКОКОВОЇ ІНФЕКЦІЇ НА ПАТОМОРФОЛОГІЧНІ ОСОБЛИВОСТІ ЛЕГЕНЕВОЇ АРТЕРІЇ НАЩАДКІВ.
ABSTRACT: Fetal infection is a serious problem in modern perinatal medicine, it is the leading cause of disease rate and mortality of the newborn babies and leads to disability of older children. The immunity of a pregnant woman is reduced, metabolic processes are rebuilt, and the organism becomes more vulnerable to various infections, in particular conditionally pathogenic. Staphylococcus aureus is the most pathogenic type of staphylococcus. Golden staphylococci can cause purulent-inflammatory processes, provoking occurrence of such more dangerous conditions, e.g. septic shock, septicemia, septicopia, meningitis, and peritonitis. This paper is aimed to study pathomorphological features of the pulmonary artery of descendants of rats born from mothers with subacute prolonged infectious and inflammatory process caused by Staphylococcus aureus. Under the influence of this pathological factor certain morphological signs of endothelial dysfunction, sclerotic processes in pulmonary artery walls, increase in the expression of interleukin-6 pro-inflammatory markers and tumor necrosis factor α are witnessed in the vessels. In future, these changes can cause cardiovascular disorders.
Keywords: pulmonary artery, descendants, staphylococcus, infectious-inflammatory process, endothelial dysfunction.
АНОТАЦІЯ: Внутрішньоутробна інфекція становить серйозну проблему сучасної перинатальної медицини, є провідною причиною захворюваності та смертності новонароджених дітей та призводить до інвалідизації дітей старших вікових груп. У вагітної жінки знижується імунітет, перебудовуються обмінні процеси, внаслідок чого організм стає більш вразливим до різних інфекцій, в тому числі, умовно-патогенних. Найбільш патогенним видом стафілокока, є Staphylococcus aureus. Золотистий стафілокок здатний викликати гнійно-запальні процеси, провокуючи виникнення таких небезпечніших станів, як септичний шок, септицемія, септикопіємія, менінгіт, перитоніт. Метою дослідження є вивчення патоморфологічних особливостей легеневої артерії потомства щурів, народжених від матерів з підгострим пролонгованим інфекційно-запальним процесом викликаним Staphylococcus aureus. Під дією вказаного патологічного фактора в судині спостерігали морфологічні ознаки ендотеліальної дисфункції, склеротичні процеси в стінках легеневої артерії,
підвищення експресії прозапальних маркерів інтерлейкіна-6 та фактора некроза пухлин α. В подальшому дані зміни можуть призводити до кардіо-васкулярних порушень.
Ключові слова: легенева артерія, нащадкі, стафілокок, інфекційно-запальний процес, ендотеліальна дисфункція.
Дане дослідження проведено в рамках науково-дослідної роботи кафедри патологічної анатомії Харківського національного медичного університету «Вплив материнсько-плодової інфекції на ембріогенез та фетогенез нащадків (клініко-морфологічне дослідження)», (номер державної реєстрації 0115U000987, 2015- 2019 рр.).
Вступ. Внутрішньоутробна інфекційна патологія становить серйозну проблему сучасної перинатальної медицини, є провідною причиною неонатальної захворюваності та смертності, призводить до інвалідизації дітей старших вікових категорій [1].
За даними літератури, внутрішньоутробна інфекція (ВУІ) розвивається у 27,4 -36,6% новонароджених дітей, народжених від матерів групи високого інфекційного ризику, а в структурі перинатальної смертності ВУІ обумовлюють від 11 до 45% втрат [2, 3]. Під час вагітності у жінки знижується імунітет, перебудовуються обмінні процеси, внаслідок чого організм стає більш сприйнятливим до різних інфекцій, в тому числі, умовно-патогенних. Найбільш патогенним для людського організму видом стафілокока, є Staphylococcus aureus. Золотистий стафілокок здатний викликати гнійно-запальні захворювання, провокуючи виникнення таких найнебезпечніших станів, як септицемія, септикопіємія, септичний шок, менінгіт, перитоніт, ендокардит, пневмонія. Дана бактерія має здатність проникати через плацентарний бар’єр, інфікуючи навколоплідні води, плодові оболонки, що на ранніх термінах гестації може закінчитися мимовільним абортом, гострим інфікуванням плода, а у новонароджених дітей аж до розвитку сепсису.
У вагітних жінок з вірусними та / або бактеріальними захворюваннями в 50-60% розвивається субкомпенсована і декомпенсована плацентарна дисфункція [4, 5], обумовлена структурними і функціональними змінами в посліді, гемодинамічними порушеннями, запальним процесом, і проявляється внутрішньоутробною гіпоксією, що часто переходить в постнатальну асфіксію [6, 7].
За даними світової статистики, асфіксія при народженні є причиною 23% всіх випадків смерті новонароджених дітей [8,9,10]. Перенесена гіпоксія сприяє виникненню патології в подальшому онтогенетичному розвитку дитини, що, в першу чергу, відбивається на стані центральної нервової системи, в 40-70% порушується функція серцево-судинної системи [11].
На сьогоднішній день є інформація про особливості морфології легеневої артерії плодів і новонароджених, народжених від матерів з ускладненою вагітністю [12,13,14]. Однак, аналіз літературних даних свідчить про нестачу інформації, що стосується дії материнської інфекції на патоморфологічні особливості легеневої артерії (ЛА). З огляду на актуальність теми, дане питання вимагає ретельного вивчення.
Метою даного дослідження: є вивчення морфологічних особливостей легеневої артерії потомства, народженого від матерів з підгострим пролонгованим інфекційно-запальним процесом викликаним Staphylococcus aureus.
Об’єкт і методи дослідження. Для проведення двох експериментальних досліджень використовували лабораторних щурів лінії WAG. Щурів поділили на наступні групи: в першу (група порівняння) увійшли новонароджені щурята, що перенесли гостру постнатальну гіпоксію (ГПГ), другу (основну) досліджувану групу склали плоди і новонароджені, народжені від матерів інфікованих Staphylococcus aureus.
У першому експериментальному дослідженні, з використанням герметичної барокамери, в умовах різкого зниження атмосферного тиску, змоделювали високогірну гіпоксію. Для моделювання гострої постнатальної гіпоксії новонароджені щурята одноразово, в 1-у добу життя, піддавалися впливу високогірній гіпоксії (створювалися умови відповідні підйому на висоту 7500 метрів), на протязі 20 хвилин, а потім виводилися з експерименту.
Другий експеримент спрямований на вивчення впливу інфекційної патології матері на стан органів та систем нащадків. На першому етапі роботи, експериментальним шляхом підібрали інфікуючу дозу для розвитку підгострого пролонгованого інфекційно-запального процесу. Референс-штами Staphylococcus aureus (АТСС 25923) використовувалися в якості інфекційного агента. На другому етапі, в черевній порожнині самки змоделювали інфекційно-запальний процес, після чого до них підсаджували самців, і після настання вагітності, народжене потомство (плодів і новонароджених щурят) виводили з експерименту для подальшого дослідження.
Евтаназію лабораторних щурів проводили з дотриманням всіх етичних вимог згідно з правилами «Європейської конвенції про захист хребетних тварин, яких використовували для експериментальних та інших цілей» (Страсбург, 1986), шляхом передозування тіопенталу натрію з подальшою декапітацією.
Після огляду легеневої артерії, вилученої під час розтину, набирали шматочки для подальшого морфологічного дослідження. Для виготовлення мікропрепаратів, фрагмент тканини судини фіксували в 10% розчині формаліну, заливали парафіном, з блоків робили зрізи товщиною 4-5×10-6м і фарбували методом за Маллорі, гематоксиліном та еозином, пікрофуксином за ван Гізоном. Вивчення гістологічних препаратів проводили на мікроскопі «Olympus BX-41» з обробкою програмою «Olympus DP-soft version 3.1. Імуногістохімічне дослідження проводили на парафінових зрізах товщиною 5-6 мкм непрямим методом Кунса. Клітини інтерлейкін-продуценти визначали за допомогою моноклональних антител (МКАт) до інтерлейкіну-6 (ІЛ-6) та фактору некроза пухлин α (ФНП α) фірми Novocastra Laboratories Ltd. Адгезивні властивості ендотеліальних клітин визначали МКАт до CD34. Колагени I, ІІІ, IV типів визначали МКАт фірми Novocastra Laboratories Ltd, UK. Мікропрепарати вивчали в люмінесцентному мікроскопі «Axioskor 40». Отриманий в результаті роботи цифровий матеріал обробляли методами математичної статистики із застосуванням пакета прикладних програм IBM SPSS Statistics 22. Для оцінки відмінностей між двома малими вибірками застосовували непараметричний статистичний U-критерій Манна-Уїтні (Mann-Whitney U test).
Результати дослідження та їх обговорення. Огляд судини проводили за допомогою лупи (×3,8 діоптрій). Легенева артерія була еластичною, з гладкою внутрішньою оболонкою білувато-сіруватого кольору, в обох досліджуваних групах.
У новонароджених щурят, що перенесли гостру постнатальну гіпоксію, та увійшли до групи порівняння, при мікроскопічному дослідженні в стінці легеневої артерії визначалося три оболонки: tunica intima – внутрішня оболонка, tunica media – середня і tunica adventitia – зовнішня (рис. 1). Ендотелій, базальна мембрана, сплетіння еластичних волокон утворюють інтиму судини, яка без чітких меж переходить в медію. Відносні обсяги tunica intima і media склали 54,74±14,36 %, tunica adventitia – 45,4±14,36 %.
На базальній мембрані розташовувалися одноядерні ендотеліальні клітини різні за формою та розміром, середня площа яких склала 14,76±0,57×10-11 м2. Середня висота клітин дорівнювала 2,81±0,05×10-6 м, ширина 5,95±0,15×10-6 м, отримані цифри свідчать про сплющення ендотеліального покриву в порівнянні з групою потомства, народженого від інфікованих матерів. Середня площа ядер достовірно зменшена по відношенню до основної досліджуваної групи (7,59±0,30×10-11 м2, p<0,05). Площа цитоплазми в середньому становила 7,16±0,37×10-11 м2, ядерно-цитоплазматичне співвідношення (ЯЦС) – 1,08±0,04. В одному полі зору (×1000) зазначалося від 2 до 6 десквамованих ендотеліоцитів (4,36±0,27). Місцями відмічалися дрібні, слабо люмінесцентні ділянки світіння інтерлейкіну-6 (1,800±0,13) та фактору некроза пухлин α (1,766±0,12). Оптична щільність інтенсивності світіння ендотеліоцитів була відображена маркером CD34 и становила 0,720±0,01 ум. од. св. Пофарбовані еозином базальні мембрани відокремлювали ендотеліальні клiтини від сполучної ткaнини, містили характерний для їх структури IV тип колагену, який визначається у вигляді інтенсивного світіння (0,901±0,01 ум. од. св.). Також, базальні мембрани помірно накопичували нехарактерний для них III тип колагену (0,568±0,01 ум. од. св.), що, ймовірно, свідчить про наявність склеротичних змін.
Підендотеліальний шар (шар Лангханса) включав в себе гладкі м’язові клітини, клітини зірчастої форми, пухку тонкофібрилярну сполучну тканину, що рівномірно накопичувала колаген IІІ і I типів. Колаген I типу був у вигляді слабкого світіння (0,264 ум. од. св.).
Медіальна оболонка легеневої артерії сформована еластичними та колагеновими волокнами. Розрахунок відносних обсягів показав переважання еластичних волокон (63,41±10,26%) над колагеновими (36,73±10,26%) (p<0,05). Незважаючи на те, що гіпоксія є стимулом для синтезу колагену, отримані дані, мабуть, можна пояснити активацією білків фібулінів, фібрилінів та емілінів, що відповідають за формування еластичних волокон [15,16] (рис. 3).
Еластичні і колагенові волокна, лімфатичні судини, помірно повнокровні vasa vasorum, nervi vasorum з відсутністю ознак дистрофії входили до складу адвентиції. Спостерігалося посилення фуксинофілії при фарбуванні судини пікрофуксином за ван Гізоном, що говорить про наявність склеротичних змін в даній оболонці легеневої артерії (рис. 5).
Основну досліджувану групу склали плоди і новонароджені щурята, народжені матерями інфікованими золотистим стафілококом. Легенева артерія також складалася з внутрішньої, середньої і зовнішньої оболонок (tunica intima, tunica media, tunica adventitia). Показники відносних обсягів tunica adventitia достовірно зменшувалися (34,28±8,65%, p<0,05) в порівнянні з групою новонароджених, що перенесли дію гострої постнатальної гіпоксії, а обсяги tunica intima і tunica media достовірно збільшувалися (65,89±8,65 %, p<0,05), дані показники, ймовірно, можна розцінювати як розвиток склеротичних процесів у зазначених оболонках, внаслідок тривалої дії патологічного фактора [17] (рис. 2).
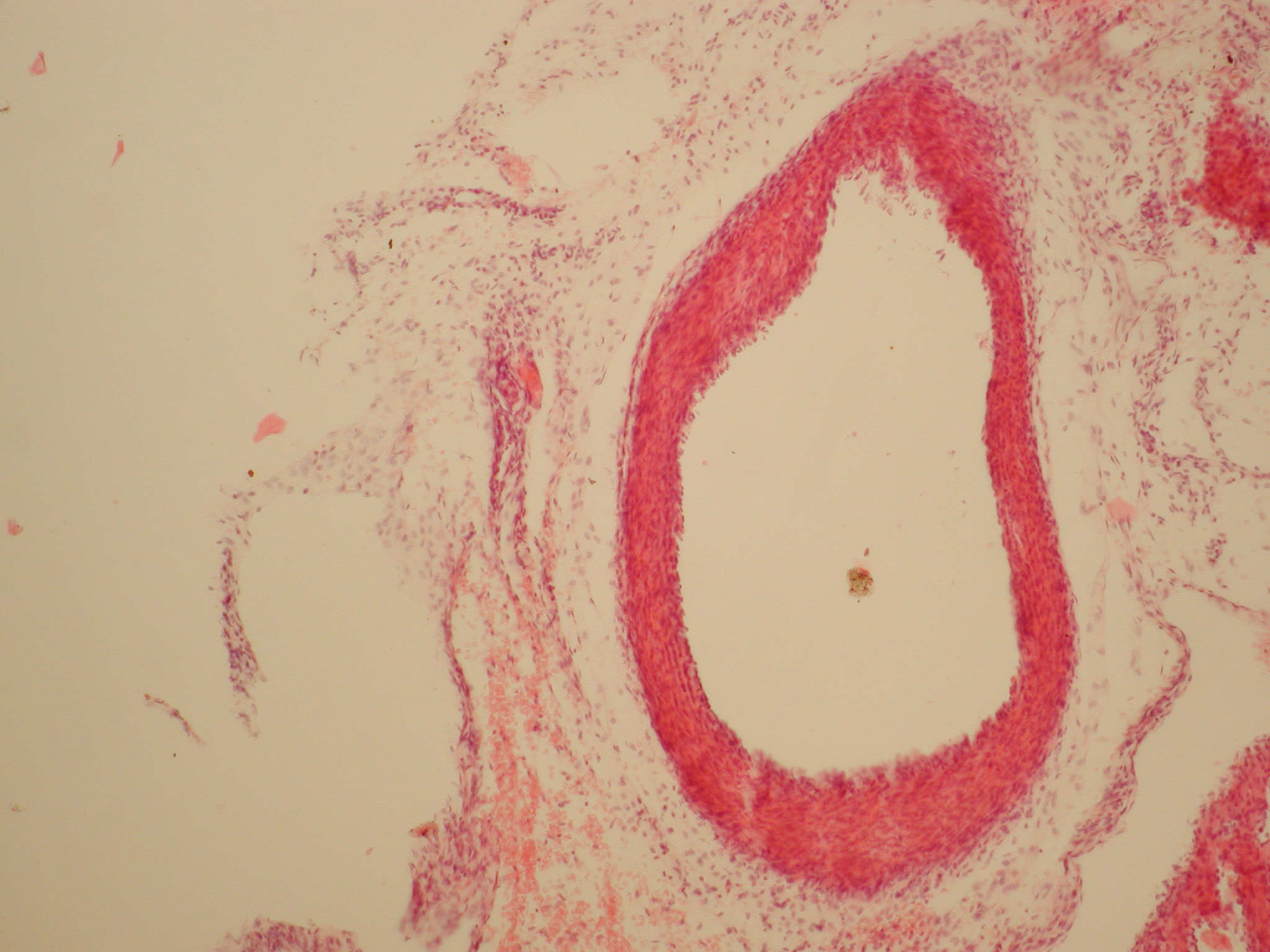
Рис.1. Легенева артерія новонародженого щура з групи порівняння. Визначається внутрішня, середня та зовнішня оболонки у стінці судини. Забарвлення гематоксиліном та еозином, ×100.
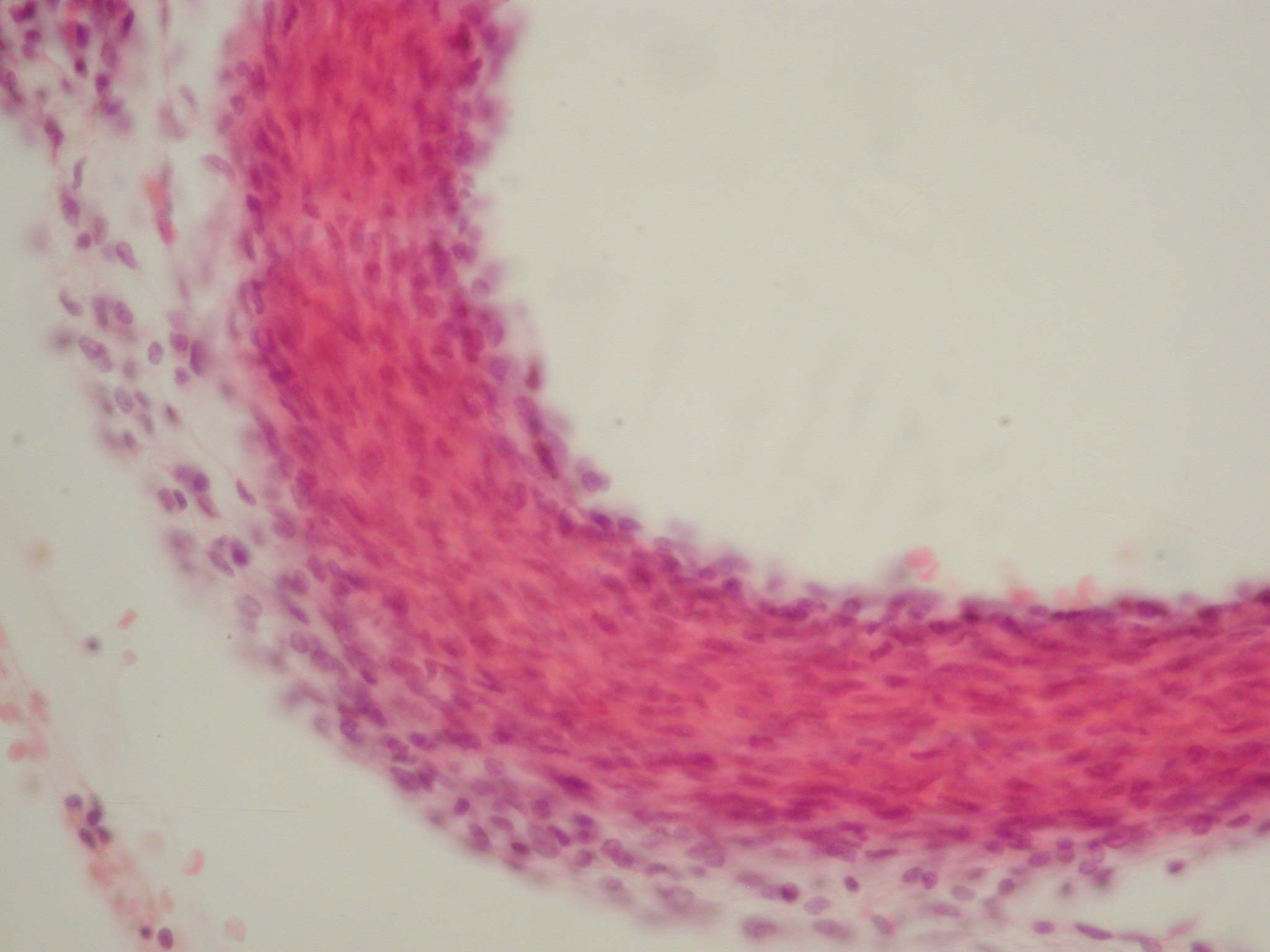
Рис.2. Легенева артерія новонародженого щура з основної досліджуваної групи. Визначається внутрішня, середня та зовнішня оболонки у стінці судини. Забарвлення гематоксиліном та еозином, ×400.
На базальній мембрані розташовані одноядерні клітини, середня площа яких склала 18,46±0,52×10-11 м2, середня ширина – 6,66±0,05 ×10-6 м, висота – 3,14±0,04×10-6 м, що достовірно більше показників групи, що перенесла ГПГ (p<0,05).У порівнянні з даними першої групи, спостерігалося достовірне збільшення середньої площі ядер (9,59±0,27×10-11 м2, p<0,05), середньої площі цитоплазми (8,86±0,42×10-11 м2, p<0,05) та ядерно-цитоплазматичного співвідношення (1,12±0,06, p<0,05). На відміну від групи щурят, що піддавалися впливу гострої гіпоксії, десквамація ендотеліоцитів в одному полі зору (×1000) достовірно зменшувалася і становила – 2,50±0,42 (p<0,05). Отримані результати, ймовірно, пояснюються тим, що при підгострому пролонгованому інфекційно-запальному процесі встигли розвинутися компенсаторно-пристосувальні реакції. Гіпоксія ж, мала гострий характер в даному експериментальному дослідженні, маючи стресорний вплив на судини, що викликало збільшення кількості десквамованих ендотеліальних клітин.
В групі нащадків, що народились від матерів, чия вагітність перебігала на тлі інфекційної патології, відзначається виражене підвищення експресії прозапальних маркерів інтерлейкіну-6 (8,700±0,23) та фактору некроза пухлин α (10,733±0,19) [18]. Це свідчить про посилення продукції прозапальних цитокінів при внутрішньоутробної інфекції [19]. Оптична щільність інтенсивності світіння ендотеліальних клітин була відображена маркером CD34 та склала 0,675±0,01 ум. од. св. Рівномірно забарвлена еозином базальна мембрана містила нехарактерний для неї колаген III типу, що виявлявся у вигляді інтенсивної імунофлюоресценції (0,681±0,03 ум. од. св.), що достовірно більше в порівнянні з першою групою. [20]. Колаген IV типу інтенсивно нерівномірно накопичувався базальною мембраною, його оптична щільність світіння склала 0,837±0,04 ум. од. св. Підендотеліальний шар сформований гладкими міоцитами, пухкою волокнистою сполучною тканиною, що містила колагени I та III типів, клітинами зірчастої форми. Порівняно з групою, що перенесла гостру постнатальну гіпоксію, дещо сильніше накопичувався колаген I типу, про що свідчило підвищення рівня оптичної щільності світіння – 0,321±0,03 ум. од. св. Отримані дані можна трактувати, як розвиток більш виражених склеротичних змін у зазначеній групі, що можливо, пояснюється тим, що внутрішньоутробне інфікування супроводжується розвитком фетоплацентарної дисфункції, що є причиною хронічної внутрішньоутробної гіпоксії плода [21], яка, в свою чергу, за даними літератури, стимулює колагеноутворення [22,23].
Тunica media складалася з еластичних і колагенових волокон, їх відносні обсяги становили 76,51±12,23% і 23,66±12,23% відповідно (рис. 4).

Рис. 3. Легенева артерія новонародженого щура з групи порівняння. Розташування колагенових і еластичних волокон у стінці судини. Забарвлення за Маллорі, ×400.
Рис. 4.Легенева артерія новонародженого щура з основної досліджуваної групи. Розташування колагенових і еластичних волокон у стінці судини. Забарвлення за Маллорі, ×400.
Тunica adventitia сформована нервовими волокнами в яких були відсутні ознаки дистрофії, лімфатичними судинами, еластичними і колагеновими волокнами, помірно повнокровними кровоносними судинами. При фарбуванні препарату пікрофуксином за ван Гізоном в зовнішній оболонці легеневої артерії спостерігали посилення фуксінофіліі, що свідчить про наявність помірно виражених склеротичних процесів [24] (рис. 6).
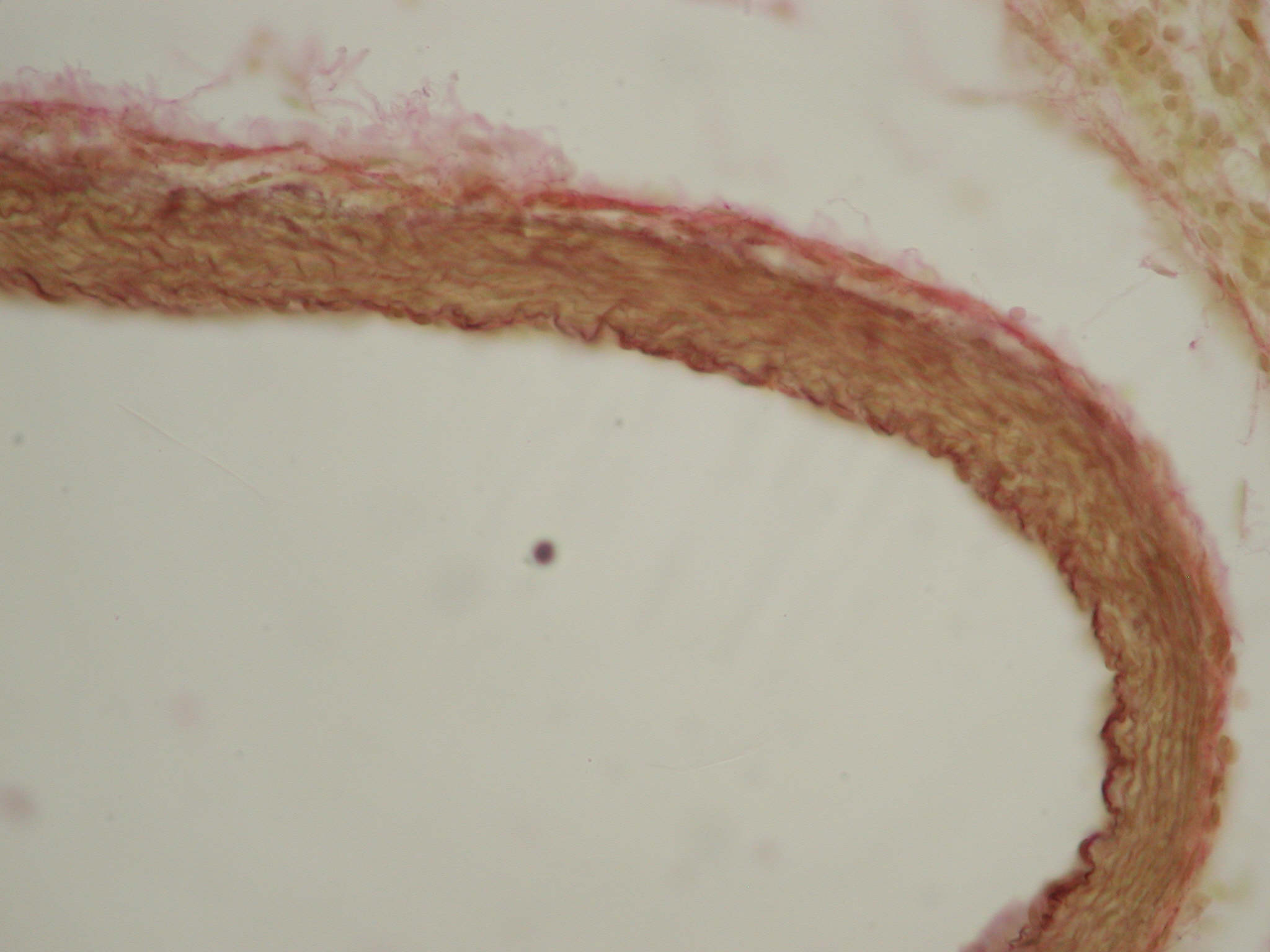
Рис. 5. Легенева артерія новонародженого щура з групи порівняння. Посилення фуксинофілії в адвентиції судини. Забарвлення за ван Гізоном, ×400.

Рис. 6. Легенева артерія новонародженого щура з основної досліджуваної групи. Посилення фуксинофілії в адвентиції судини. Забарвлення за ван Гізоном, ×400.
Висновки
1. У легеневої артерії обох досліджуваних груп, виявлено структурні пошкодження, що проявляються в сплющенні ендотеліоцитів, місцями розташованих вертикально по відношенню до базальної мембрани, з їх подальшою десквамацією більш вираженою в групі новонароджених щурят, що перенесли гостру гіпоксію (що ймовірно пов’язано з гостротою процесу), що є морфологічним проявом ендотеліальної дисфункції. В обох групах, в tunica adventitia виявлені помірно виражені склеротичні зміни.
2. У групі народженої від матерів з підгострим пролонгованим інфекційно-запальним процесом викликаним Staphylococcus aureus, середня товщина судини збільшувалася в порівнянні з групою щурят, які зазнали впливу гострої постнатальної гіпоксії, за рахунок tunica intima і tunica media. Спостерігалось зростання показників оптичної щільності інтенсивності світіння колагенів I та III типів, появою невластивого колагену III типу в структурі базальних мембран, що можна розцінювати як розвиток склеротичних процесів, внаслідок тривалої дії інфекції, що погіршує трофіку, знижує еластичні властивості стінок легеневої артерії. Відмічається достовірне збільшення експресії прозапальних маркерів ФНП α та ІЛ-6, що свідчить про проникність материнських антитіл до плоду, і реалізації внутрішньоутробної інфекції.
3. Під дією гострої постнатальної гіпоксії у стінці ЛА змінюється кількісне співвідношення волокон в бік переважання еластичних, що ймовірно, можна пояснити активацією білків фібулінів, фібрилінів та емілінів, що відповідають за формування зазначеного виду волокон.
Перспективність дослідження: буде проведено морфологічне та імуногістохімічне дослідження легеневої артерії померлих новонароджених дітей для порівняльного анализу з експериментальним матеріалом.
Література
1. Кривицкая Л. В. Внутриутробные инфекции. Сепсис новорожденных: учеб.-метод. пособие./ Л. В. Кривицкая, Ж. П. Кравчук, И. Н. Струповец. Гомель: ГГМУ, 2010. – 64 с.
2. Сенчук А.Я., Дубоссарская З.М. Перинатальные инфекции. – М.: МИА, 2005. – 318 с.
3.Орджоникидзе Н.В., Агаронян Н.Г. Современные аспекты внутриутробной инфекции // Журнал Российского общества акушеров-гинекологов. – 2005. – №1. – С. 8–12.
4.Каптильный В.А. Инфекция мочевыводящих путей во время беременности. / В.А. Каптильный// Архив акушерства и гинекологии им. В.Ф. Снегирева. – 2015. – № 2 (4). – С.10–19.
5. Бондаренко Н.П., Лакатош В.П., Белая В.В., и др. / Клинико-эпидемиологические аспекты В19-парвовирусной инфекции при беременности (клиническое исследование). // Health of woman. – 2015. – № 6(102): – С. 89–93; doi 10.15574/HW.2015.102.89.
6. Кузьмин, В.Н. Инфекции, передаваемые половым путем, в проблеме репродуктивного здоровья женщин / В.Н. Кузьмин // Лечащий врач. – 2009. – № 11.
7. Островская, О.В. Прогностическая ценность маркеров активизации внутриутробных инфекций / О.В. Островская, Т.В. Комиссарова, Е.В. Ваганова и соавт. // Дальневосточный медицинский журнал. – 2007. – № 1. – С. 50–53.
8. Zanelli S.A. Hypoxic-ischemic encephalopathy / S.A. Zanelli, D.P. Stanley, D. Kaufman. – 2012. – URL: http://emedicine.medscape.com/article/973501.
9. Raju Tonse, N.K. Hypoxic-ischemic brain injury in the newborn / N.K. Raju Tonse, T. Rosenkrantz, R. Konop. – 2003. – URL: http://www.emedicine.com/ped/byname/ hypoxic-ischemic-encephalopathy.htm.
10. De Menezes M.S. Hypoxic-ischemic brain injury in the newborn / M.S. de Menezes. – 2013. – URL: http:// emedicine.medscape.com/article/1183351.
11.Прахов А.В. Систематизация неонатальных функциональных кардиопатий/ А.В. Прахов // Российский вестник перинатологии и педиатрии – 2010. – № 2. – С.14–18.
12. Яковцова А.Ф., Марковський В.Д., Сорокіна І.В. та інші./ Морфофункціональні особливості серцево-судинної системи плодів і новонароджених від матерів з ускладненою вагітністю: основні здобутки харківської школи патологоанатомів. // Патологія. –2015. – №1 (33). – C.12 – 16.
13. Калужина О. В. Влияние хронической внутриутробной гипоксии на морфологическое состояние легочной артерии у плодов и новорожденных (экспериментальное исследование) / О. В. Калужина // Вісник Української медичної стоматологічної академії. – 2015. – Том 15, Вип. 1 (49). – С. 168–171.
14. Марковський В. Д. Морфологічні особливості легеневої артерії у плодів і новонароджених від матерів з прееклампсією / В. Д. Марковський, І. В. Сорокіна, О. В. Калужина // Експериментальна і клінічна медицина. – 2014. – № 3. – С. 86–90. – Режим доступу: http://nbuv.gov.ua/UJRN/eikm_2014_3_21.
15. Камоева С.В. Ферментные и генетические аспекты патогенеза пролапса тазовых органов и дисфункции тазового дна у женщин / С.В. Камоева // Российский вестник акушера-гинеколога. – 2013. – №3. – С. 31–35.
16. Калужина О. В. Влияние хронической внутриутробной гипоксии на морфологическое состояние легочной артерии у плодов и новорожденных (экспериментальное исследование) / О. В. Калужина // Вісник Української медичної стоматологічної академії. – 2015. – Т. 15. – № 1 (49). – С. 168–171.
17. Шаврин А.П., Ховаева Я.Б., Головской Б.В. / Состояние толщины комплекса интима-медиа сонных артерий, иммунной системы, инфицированности организма у лиц с разным количеством факторов риска. // Практическая медицина. – 2011. – № 4 (52). – С. 181–184.
18. Локтионова И.Л., Покровский М.В., Рагулина В.А. и др. / Состояние функции сосудистого эндотелия при инфекционной патологии различной этиологии. // Научные ведомости. Серия медицина. Фармация. – 2012. – № 4 (123). Выпуск 17/1. – С. 20–31.
19. Тирская Ю. И., Белкова Т. Н., Шамина И. В., Барбанчик И. А., Чуловский Ю. И., Корнеев Б. В. Иммунологические особенности беременных группы риска по внутриутробной инфекции // Journal of Siberian Medical Sciences. 2014. №2. URL: https://cyberleninka.ru/article/n/immunologicheskie-osobennosti-beremennyh-gruppy-riska-po-vnutriutrobnoy-infektsii (дата обращения: 06.10.2018). КиберЛенинка: https://cyberleninka.ru/article/n/immunologicheskie-osobennosti beremennyh-gruppy-riska-po-vnutriutrobnoy-infektsii.
20. Сравнительная характеристика морфологических изменений эндотелия легочной артерии и аорты у плодов и новорожденных от матерей с преэклампсией // Universum: Медицина и фармакология : электрон. научн. журн. Марковский В.Д. [и др.]. 2014. № 8 (9) . URL: http://7universum.com/ru/med/archive/item/1523.
21. Цхай В.Б., Прахин Е.И., Даценко А.В., Ульянова И.О. Особенности перинатального периода при внутриутробном инфицировании // Российский вестник перинатологии и педиатрии. – 2002. – № 6. – С. 14–17.
22. Falanga V. Low oxygen tension stimulates collagen synthesis and COL1A1 transcription through the action of TGF-β1 / V. Falanga, L. Zhou, T. Yufit // Journal of Cellular Physiology. – 2002. – Vol. 191, Issue 1. – P. 42–50.
23. Rauch F., Georg M., Stabrey A. Collagen markers deoxypyridinoline and hydroxylysine glycosides: Pediatric reference data and use for growth prediction in growth hormone deficient children // Clin Chem. – 2002. – V.48. – №2. P.–315–322.
24. Майорова М.В., Демидов В.И., Конкина Е.А. Патоморфология миокарда у умерших от ишемической болезни сердца и сахарного диабета // Вестник Ивановской медицинской академии. – 2011. – Т. 16. – № 3. С. 13–18.