Химические науки
Mamaenko A. V.
leading engineer of the department of chemistry, physics and biology of water,
Dumansky Institute of Colloid Chemistry and Water Chemistry of the National Academy of Sciences of Ukraine, Kyiv
Dolenko S.A.
doctors of philosophy, senior researcher of the department of analytical and radiochemistry,
Dumansky Institute of Colloid Chemistry and Water Chemistry of the National Academy of Sciences of Ukraine, Kyiv
Zuy O.V.
doctor of chemical sciences, senior researcher of the department of analytical and radiochemistry,
Dumansky Institute of Colloid Chemistry and Water Chemistry of the National Academy of Sciences of Ukraine, Kyiv
Prikhod’ko R.V.
doctor of chemical sciences, senior researcher of the department of chemistry, physics and biology of water,
Dumansky Institute of Colloid Chemistry and Water Chemistry of the National Academy of Sciences of Ukraine, Kyiv
Goncharuk V.V.
doctor of chemical sciences, professor,
Dumansky Institute of Colloid Chemistry and Water Chemistry of the National Academy of Sciences of Ukraine, Kyiv
Мамаенко Александр Витальевич
ведущий инженер отдела химии, физики и биологии воды,
Институт коллоидной химии и химии воды им. А.В. Думанского НАН Украины, г. Киев
Доленко Светлана Александровна
кандидат химических наук, старший научный сотрудник отдела аналитической та радиохимии,
Институт коллоидной химии и химии воды им. А.В. Думанского НАН Украины, г. Киев
Зуй Олег Викторович
доктор химических наук, старший научный сотрудник отдела аналитической та радиохимии,
Институт коллоидной химии и химии воды им. А.В. Думанского НАН Украины, г. Киев
Приходько Роман Викторович
доктор химических наук, старший научный сотрудник отдела химии, физики и биологии воды,
Институт коллоидной химии и химии воды им. А.В. Думанского НАН Украины, г. Киев
Гончарук Владислав Владимирович
доктор химических наук, профессор
Институт коллоидной химии и химии воды им. А.В. Думанского НАН Украины, г. Киев
APPLICATION OF ION CHROMATOGRAPHY FOR ESTABLISHING THE MECHANISM OF ANIONIC SURFACTANTS DESTRUCTION BY VACUUM UV IRRADIATION AND CORONA DISCHARGE
ИСПОЛЬЗОВАНИЕ ИОННОЙ ХРОМАТОГРАФИИ ДЛЯ УСТАНОВЛЕНИЯ МЕХАНИЗМА ДЕСТРУКЦИИ АПАВ ВАКУМНЫМ УФ-ИЗЛУЧЕНИЕМ И КОРОННЫМ РАЗРЯДОМ
Summary: Chromatographic analysis of the products of oxidative destruction of sodium dodecyl sulfate (DDSNa) in the treatment of its aqueous solutions with VUV radiation (185 nm) and corona positive discharge has been carried out. It allowed to propose the mechanisms of destruction of linear anionic surfactants. It has been established that at VUV treatment a number of oxygen-containing radicals can participate in the oxidative degradation of 10 mg/dm3 DDSNa: ·OH, CO3—· and SO4—·. When processing with plasma ·OH do not participate in the oxidative degradation, since their formation occurs in the upper thin layer of the liquid and the rate of their recombination is higher than the rate of diffusion into the volume. It has been experimentally proved that the high concentrations of total organic carbon observed during plasma and vacuum UV treatment can be due to the recombination of the carbonate radicals formed into organic peroxides or oxalate anions.
Key words: anionic surfactants, destruction, pulse positive corona discharge, vacuum ultraviolet radiation, ion chromatography.
Аннотация: Проведен хроматографический анализ продуктов окислительной деструкции додецилсульфата натрия (ДДСН) при обработке его водных растворов ВУФ-излучением (185 нм) и коронным положительным разрядом. Это позволило предложить механизмы деструкции линейных анионных поверхностно-активных веществ. Установлено, что при ВУФ-обработке в окислительной деструкции 10 мг/дм3 ДДСН кроме жесткого УФ-излучения могут принимать участие ряд кислородсодержащих радикалов: ·ОН, СО3—· и SO4∙–. При обработке плазмой ·ОН не принимают участие в окислительной деструкции, так как их образование происходит в верхнем тонком слое жидкости и скорость их рекомбинации выше, чем скорость диффузии в объем. Экспериментально доказано, что наблюдаемые в процессе обработки плазмой и вакуумным УФ-излучением высокие значения концентрации общего органического углерода могут быть обусловлены рекомбинацией образующихся карбонатных радикалов в органические пероксиды или оксалат-анионы.
Ключевые слова: анионные ПАВ, деструкция, импульсный положительный коронный разряд, вакуумное ультрафиолетовое излучение, ионная хроматография.
Актуальность. Современная экологическая ситуация обуславливает необходимость очистки сточных вод от поллютантов, среди которых особо можно выделить анионные поверхностно-активные вещества (АПАВ), которые являются одними из основных компонентов стоков городских очистных сооружений. При больших объемах таких стоков широко применяются биологические методы очистки. При малых объемах сточных вод целесообразней и экономически выгодней использовать деструктивные установки для локальной очистки, в частности установки, в основе которых лежат фотохимические процессы. К достоинствам фотохимических реакций относится легкость регулирования их скорости в широких пределах с изменением интенсивности светового потока, быстрое и полное приостановление с прекращением облучения.
Анализ опубликованных работ. Органические вещества, в том числе и АПАВ, как правило, более чувствительны к свету, чем неорганические, и потому подвергаются деструкции либо в результате непосредственного поглощения квантов жесткого УФ-излучения, либо при взаимодействии с продуктами фотолиза воды – ОН радикалами, которые являются мощными окислителями (окислительный потенциал составляет 2,7 эВ [1]). Поэтому, технологии, использующие жесткое УФ-излучения ( 200 нм) вакуумное ультрафиолетовое (ВУФ) излучение [2, 3], а также разные электроразрядные методы [4], способствующие процессу разложения воды, с прикладной точки зрения представляет большой интерес, как в связи с образованием в них высокореактивных ОН радикалов, так и благодаря прямому их воздействию на молекулы поллютантов. Кроме того рассматриваемые процессы безреагентны или требуют малых затрат реагентов, что повышает перспективность их применения.
Несмотря на сказанное применению продуктов непосредственно ВУФ фотолиза воды для ее очистки от органических загрязнителей посвящено ограниченное количество работ, что было связано с отсутствием приемлемых источников ВУФ-излучения. Возможности существующих УФ источников ограничены, что обусловило развитие технологий с использованием дополнительных компонентов. Так в облучаемые водные системы вводят окислители такие, как Н2О2, О3, или фотокатализаторы, например, диоксид титана [5]. Появление новых источников с излучением в коротковолновых областях, открыло новые возможности дальнейшего совершенствования окислительных технологий. Так в [6] исследовался процесс деградации органических загрязнителей в водном растворе под действием излучения ксеноновой лампы (=172 нм). Было показано, что первичные процессы фоторазложения и деградации загрязнителей происходят в тонком слое воды, вблизи стенки облучателя. Радикал ·ОН взаимодействует с органическими добавками вида RH с образованием С-центрированных радикалов R·, дальнейшее окисление которых происходит с участием молекул кислорода, приводя практически к полной минерализации.
В работе [7] проведено сравнение нескольких методов очистки воды от органических загрязнителей: с использованием ВУФ излучения, солнечного света с применением катализаторов TiО2 и ионизирующего излучения. Установлено, что разложение органических молекул происходит двумя путями: при прямом поглощении ВУФ излучения данными молекулами и при их взаимодействии с продуктами ВУФ фотолиза воды.
Однако широкомасштабное применение этих процессов с целью обработки сточных вод все еще ограничено в частности тем, что наблюдается дефицит данных, необходимых для моделирования и масштабирования фотореакторов. В частности кинетика и механизмы разложения органических соединений при использовании фотохимических процессов изучены недостаточно.
Цель данной работы. Установление механизмов разложения АПАВ при обработке их водных растворов коронным положительным разрядом и вакуумным УФ-излучением. Для этого в данной работе, используя ионную хроматографию, проведены исследования по установлению основных продуктов разложения АПАВ, которые могут служить основой для определения механизма и численного моделирования кинетики химических процессов, протекающих в растворе ПАВ.
Результаты и обсуждения. В качестве объектов исследования были использованы водные растворы додецилсульфата натрия (ДДСН). Препарат ДДСН квалификации «ч» использовали после дополнительной очистки трехкратной перекристаллизацией из абсолютного этанола; содержание основного вещества, установленное методом двухфазного титрования [8], составляло не менее 98 %. Рабочие растворы готовили путем растворения навесок в дистиллированной воде.
Для обработки исследованных образцов воды применяли положительный коронный разряд через газовую фазу при напряжении 15 кВ и силе тока 350 μА [9], а также УФ-облучение. В качестве УФ-излучателя со спектральной областью излучения 185254 нм использовали кварцевую аргонно-ртутную лампу низкого давления ДРБ-20 в очень тонком слое жидкости.
Концентрацию пероксида водорода определяли по методике, основанной на окислении восстановленной формы фенолфталеина пероксидом водорода в присутствии ионов меди (II) в качестве катализатора [10].
Процесс деструкции ДДСН оценивали по его остаточной концентрации в растворе и по содержанию общего органического углерода. Остаточные концентрации ДДСН после деструкции определяли экстракционно-фотометрическим методом с использованием метиленового синего [11]. Анализ общего органического углерода (ООУ) проводили методом высокотемпературного каталитического окисления органического углерода на платиновом катализаторе с использованием анализатора общего органического углерода TOC – VCSN (Shimadzu).
Продукты деструкции АПАР, а также концентрацию нитрат-, сульфат- и оксалат-ионов в модельных растворах определяли на ионном хроматографе Цвет-3006 с кондуктометрическим детектором при с использовании колонки ANIEKS-N 6×100 мм. Автоматическая запись хроматограмм в режиме реального времени проводилась с помощью совместимого с персональным компьютером аналого-цифрового преобразователя и соответствующей обслуживающей программы. В качестве элюента использовали 5·10-3 M раствор Na2CO3. Элюент подавали насосом высокого давления. Скорость потока элюента составляла 2,0 см3/мин.
Для отделения продуктов деструкции от остаточного содержания АПАВ использовали картриджи, заполненные сорбентом на основе стирол дивинил бензольного полимера, Strata SDB-L (Phenomenex) с обращено-фазовым способом удерживания. Подготовку сорбента проводили следующим образом: через колонку с сорбентом пропускали 5-8 см3 ацетона, его остатки выдували воздухом и промывали 15-20 см3 дистиллированной воды. Предварительно было установлено, что степень извлечения ДДСН данным сорбентом составляет 97 %.
На рис. 1 представлена кинетика и эффективность разложения додецилсульфата натрия при обработке его водных растворов коронным положительным разрядом (а) и вакуумным УФ-излучением (б). Из рисунка видно, что при обработке водных растворов ДДСН положительным коронным разрядом и вакуумным УФ-излучением наблюдается падение остаточной концентрации АПАВ в растворе. Причем скорость деструкции при ВУФ-облучении значительно выше, чем при обработке плазмой. Следует отметить, что в обоих случаях полной минерализации не наблюдается. Кроме того имеет место увеличение содержания общего органического углерода. Причем в случае ВУФ-облучения увеличение более выраженное.
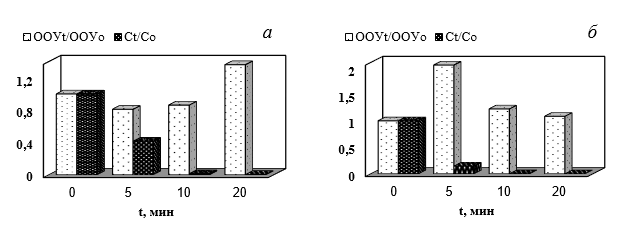
Рисунок 1 Кинетика разложения ДДСН по изменению его концентрации и содержания общего органического углерода в процессе действия коронного разряда (а) и вакуумного УФ-излучения (б´). СДДСН = 10 мг/дм3; Т = (22 ± 2) ºС.
Для объяснения наблюдаемого эффекта, используя метод ионной хроматографии, были проведены исследования по установлению продуктов деструкции ДДСН при обработке их водных растворов коронным разрядом и вакуумным УФ-излучением. Для отделения ДДСН от его продуктов деструкции обработанные растворы были пропущены через картридж с сорбентом SDB-L. Соответствующие хроматораммы представлены на рис. 2, 3.
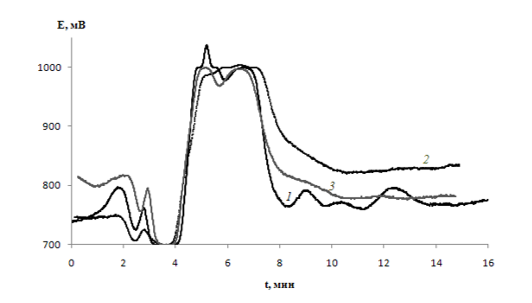
Рисунок 2 Хроматограммы водных растворов ДДСН после их обработки вакуумным УФ-излучением. СДДСН = 10 мг/дм3; Т = (22 ± 2) ºС; время обработки, мин: 5 (1), 10 (2) и 20 (3). Элюент 5·10-3 M раствора Na2CO3.
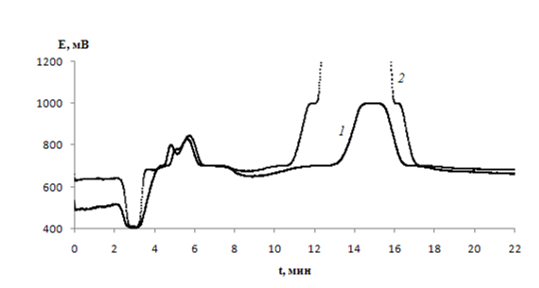
Рисунок 3 Хроматограммы водных растворов ДДСН после их обработки коронным разрядом. СДДСН = 10 мг/дм3; Т = (22 ± 2) ºС; время обработки, мин: 5 (1), 20 (2) . Элюент 5·10-3 M раствора Na2CO3, скорость потока 2 мл/мин.
Для расшифровки полученных хроматограмм были получены хроматограммы модельных растворов сульфат-, оксалат-, нитрат-, хлорид-анионов, а также анионов карбоновых кислот (рис. 4, 5). Указанные анионы могут образовыватся в результате фотохимической деструкции АПАВ, а хлорид-анион является макрокомпонентом природных вод.
Установлено, что при использовании в качестве элюента 5·10-3 M раствора Na2CO3 время удерживания Сl— составляет 5,15 мин, SO42- 6,7 мин, C2O42- 8,5 мин, CH3COO— 3,2 мин, HCOO— 3,4 мин, NO3— – 14,8 мин.
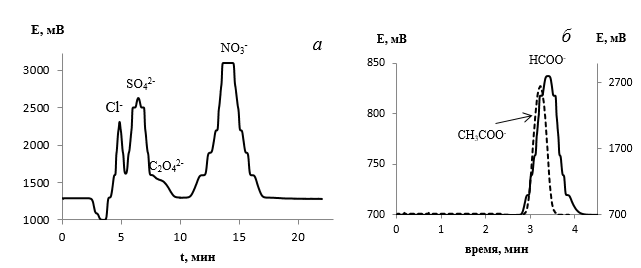
Рисунок 4 Хроматограмма модельной смеси анионов: Сl— (9,2 мг/дм3), SO42- (6,7 мг/дм3), C2O42- (5 мг/дм3) CH3COO—, HCOO—.
Деструкция анионных ПАВ, ведущая к потере поверхностной активности, может происходить либо путем отщепления от молекулы вещества гидрофильной группы, либо в результате последовательного окисления алкильного радикала. Как видно из хроматограмм, в случае ВУФ среди продуктов деструкции ДДСН можно идентифицировать монокарбоновые кислоты с разной степенью гидрофобности. Пики при ~ 3 мин можно идентифицировать как анионы короткоцепочечных монокарбоновых кислот (см. рис.4-б), а пик при ~ 5 мин в отсутствии хлоридов может соответствовать более длинноцепочечным карбоновым кислотам, что согласуется с литературными данными [12].
Таким образом, наличие карбоновых кислот различной гидрофобности
указывает на то, что деструкция ДДСН происходит в результате последовательного окисления конечной СН3-группы алкильного радикала до карбонильной и карбоксильной групп с последующим декарбоксилированием по схеме реакций Фото-Кольбе [13]:
H3 C – (CH2)n – COOH → H3 C – (CH2 )n-1 – CHO + CO2 →
H3 C – (CH2)n-1– COOH → H3 C – (CH2 )n-2 – CHO + CO2 → …
→ H3C – COOH → H – CO – H + CO2 → H – COOH → CO2 + H2O
Образующийся CO2 в виде гидрокарбонатов вместе с исходными гидрокарбонатами в исследованном образце могут взаимодействовать с ∙OH воды с образованием карбонат радикалов:
.OH + НCO3–→ H2О + CO3∙– k =8,5·106 M-1·c-1,
которые, являясь сильными окислителями (E0CO3∙–/CO32– = 1,78 В), могут принимать участие в окислении органических веществ [14, 15]. При низких концентрациях АПАВ избыток CO3∙– может привести к их рекомбинации с образованием органических пероксидов [16] или оксалат-ионов:
CO3∙– + CO3∙– ↔ С2О6 2- → С2О42– + О2
Образование С2О42– подтверждает пик, наблюдаемый при ~ 8,5 мин, который в данной хроматографической системе идентифицируется как оксалат-ион. Кроме того С2О42– может образовываться при рекомбинации СО2∙–, который образуется в системе по реакции [17, 18]:
е–ag + СО2 → ∙ СО2–
СО2∙– + СО2∙– → С2О42–
На образование органических пероксидов может указывать повышенный при 5 мин обработки (по сравнению с раствором сравнения) выход Н2О2 (рис. 6, а). Согласно [10] использованная методика позволяет определять наряду с Н2О2 и другие органические пероксиды.
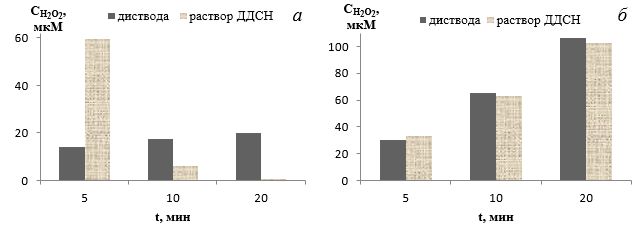
Рисунок 5 – Кинетика образования пероксида водорода в отсутствие и в присутствии при обработке модельных растворов вакуумным УФ-излучением (а) коронным разрядом і (б). САПАР = 10 мг/дм3, Т = (20 ± 2) ° С.
Наблюдаемый пик при ~ 6,6 минутах соответствует сульфат-аниону. Неизменность величины данного пика от времени обработки и соответствие найденной концентрации SO42- указывает на то, что наблюдается практически полное отщепление гидрофильной группы от молекулы ДДСН по следующей схеме:
C12H25ОSO3– + hν → C12H25 ОSO3–*
C12H25 ОSO3–* → C12H25∙ + SO4∙–
В свою очередь SO4∙–, являясь сильным окислителем (значения ОВП находится в пределах 2,5 – 3,1 В) [17], может взаимодействовать с НCO3– с образованием карбонатного радикала [19]:
SO4∙– + НCO3– → Н+ + SO42– + CO3∙–
Таким образом, образующиеся SO4∙–, CO3∙– и ·ОН могут быть ответственными за окисление углеводородного радикала молекулы ДДСН. На участие ·ОН указывает уменьшение концентрации Н2О2 при ВУФ-облучении раствора АПАВ более 10 мин (см. рис. 5,а).
Анализ хроматограмм водных растворов после деструкции ДДСН коронным положительным разрядом позволяет четко идентифицировать нитрат- и сульфат-анионы. Отсутствие монокарбоновых кислот можно объяснить образованием, например, альдегидов. На образование формальдегида при фотодеструкции АПАВ различными методами указывают и другие авторы [20]. Таким образом, можно предположить, что деструкция ДДСН происходит по иному механизму. В отличие от ВУФ, где возбуждается вся молекула АПАВ за счет поглощения кванта света, то в случае коронного разряда, на молекулу АПАВ непосредственно действуют положительные ионы (соединения азота и кислорода). Они действуют как на алкильную цепочку молекулы ДДСН, так и на сульфогруппу, отдавая ей предпочтение согласно [21].
Рис. 5,б, указывает на неучастие ·ОН в окислительных процессах при действии коронного разряда. Данный факт обусловлен тем, что образование ·ОН происходит в верхнем тонком слое жидкости, а молекулы ДДСН при исследуемой концентрации (10 мг/дм3) в основном еще сконцентрированы в объеме и недоступны для ·ОН. Конструкция же установки с ВУФ-излучателем обеспечивает доступ ·ОН к молекуле АПАВ.
Таким образом, меньшую скорость деструкции ДДСН, а также снижение концентрации сульфат-анионов, наблюдаемых на хроматограммах при обработке коронным разрядом в сравнении с применением ВУФ-излучения, можно объяснить не участием ·ОН и отсутствием прямого воздействия на молекулу при окислении АПАВ.
Выводы. Хроматографический анализ продуктов окислительной деструкции ДДСН при обработке его водных растворов ВУФ-излучением и коронным положительным разрядом позволили установить механизмы деструкции линейных АПАВ. Так при ВУФ-обработке в окислительной деструкции кроме жесткого УФ-излучения могут участвовать ряд кислородсодержащих радикалов: ·ОН, СО3—· и SO4∙–. При обработке плазмой ·ОН не принимают участие в окислительной деструкции, так как их образование происходит в верхнем тонком слое жидкости и скорость их рекомбинации выше, чем скорость диффузии в объем.
Список литературы
- Wardman P. Reduction Potentials of One-Electron Couples Involving Free Radicals an Aqueous Solutions //J. Phys. Chem. Ref. Data. 1989. V. 18, № 4. P. 1637–1756.
- Зверева Г.Н. Использование вакуумного ультрафиолетового излучения для получения высокореактивных радикалов // Оптический журнал, 2012. – Т.79, №8 . – С.45-54.
- Yuan Wang, Pengyi Zhang. Effects of pH on photochemical decomposition of perfluorooctanoic acid in different atmospheres by 185 nm vacuum ultraviolet//J. of Environmental sciences. 2014. V.26, № 11. P. 2207 – 2214.
- Muhammad Arif Malik, Abdul Ghaffar, Salman Akbar Malik. Water purification by electrical discharges// Plasma Sources Sci. Technol. 2001. V.10, №1. P. 82–91.
- Qinhai, H. Photodegradation of methyl tert-butyl ether (MTBE) by UV/H2O2 and UV/TiO2 / H. Qin-hai [et al.] // Journal of Hazardous Materials. – 2008. — V.154, №.1-3. – P. 795–803.
- Heit G., Braun A.M. VUV-photolysis of aqueous systems: spatial differentiation between volumes of primary and secondary reactions // Wat. Sci. Tech. – 1997. – V. 35, № 4. – P. 25–30.
- Gettoff N. Purification of drinking water by irradiation. A review // Proc. Indian Acad. Sci. (Chem/ Sci.). – 1993. – V. 105, № 6. – P. 373–391.
8. Поверхностно-активные вещества. Синтез, анализ, свойства, применение: Учеб. пособие для вузов / Под ред. А.А. Абрамзона. – Л.: Химия, 1988. – 200 с.
9. Mamaenko A. V., Dolenko S. A., Goncharuk V. V. Impact of a pulse corona discharge on the formation of hydrogen peroxide in different types of water // Journal of Water Chemistry and Technology. – 2016. – V. 38, N 5. – P. 255-259.
10. J. E. Frew, P. Jones, G. Scholes. Spectrophotometric determination of hydrogen peroxide and organic hydroperoxides at low concentrations in aqueous solution // Analytica Chimica Acta. – 1983. – V. 155. – P. 139-150.
11. ДСТУ ISO 7875-2008. Якість води. Метод визначення аніонних поверхнево-активних речовин. – К.: Держспоживстандарт України, 2008. – С. 2 -9.
12. Пилипенко А.Т., Зуй О.В., Терлецкая А.В. Ионохроматогафическое определение анионов в водах с использованием центрально- и поверхностно-модифицированных сорбентов// Химия и технология воды. – 1992. – Т. 14, № 11. – С. 819-825.
13. Ilisz I., Bokros A., Dombi A. TiO2-Based Heterogeneous Photocatalytic Water Treatment Combined with Ozonation // Ozone: Sci. and Eng. – 2004 –V. 26, N. 4 – P. 585 – 594.
14. C. Busset, P. Mazellier, M. Sarakha, J. De Laat. Photochemical generation of carbonate radicals and their reactivity with phenol // Journal of Photochemistry and Photobiology A: Chemistry. – 2007. V. 185, N. 2-3. – P. 127 – 132.
15. Marıa Laura Dell’Arciprete, Juan M. Soler, Lucas Santos-Juanes, Antonio Arques, Daniel O. Martire, Jorge P. Furlong, Monica C. Gonzalez. Reactivity of neonicotinoid insecticides with carbonate radicals // Water research. – 2012. – V.46, N. 11 – P. 3479 – 3489.
16. Danilo B. Medinas, Giselle Cerchiaro, Daniel F. Trindade and Ohara Augusto. The Carbonate Radical and Related Oxidants Derived from Bicarbonate // Buffer IUBMB Life. – 2007 – V.59, N. 4 – 5. – P. 255 – 262.
17. P. Neta and Robert E. Huie, Alberta B. Ross. Rate Constants for Reactions of Inorganic Radicals in Aqueous Solution //J. Phys. Chem. Ref. Data. – 1988. — Vol. 17, N 3. — P.1027-1284.
18. J. A. Rosso, S. G. Bertolotti, A. M. Braun, D. O. Ma´rtire, M. C. Gonzalez. Reactions of carbon dioxide radical anion with benzenes// J. Phys. Org. Chem. -2001. – V.14, N. 5. – P. 300 – 309.
19. Canonica, S., et al., Photosensitizer method to determine rate constants for the reaction of carbonate radical with organic compounds. Environmental Science & Technology. – 2005 – V. 39, N. 23 – P. 9182 – 9188.
20. D. A. Shutov, A. S. Konovalov, A. A. Isakina, and E. S. Bobkova. Destruction of sulfonol in its aqueous solutions by contact glow discharge treatment: 2.Mechanisms and kinetic simulation// High Energy Chemistry. – 2013. – V. 47, № 5. – Р. 258–261.
21. Черняк В.Я., Тарасова Я.Б., Трофимчук А.К., Зражевский В.А., Юхинко В.В. Деструкция растворённых в воде поверхностно-активных веществ и фенола под действием плазмы несамостоятельного разряда // Химия и технология воды.− 2002. − Т.24, №6. − С.547–557.